
KRAS G12D突变是KRAS突变最为常见的一类,其发生率约为G12C突变的2.5倍,且更多的出现在难治性或治疗预后效果差的癌症类型中。胰腺癌,素有“癌症之王”之称,治疗手段和治疗药物都极其有限,患者5年生存率仅10%,多数患者确诊后生存期仅为1年左右,是所有常见癌症中生存率最低的。研究显示,大约90%的胰腺癌患者都存在KRAS突变,其中KRAS G12D突变占比最高,达到45%(G12C突变仅为1%)。此外,在全球总体发病率排名第三的结直肠癌中,G12D突变在含KRAS突变的结直肠癌患者中占比也达到了45%。因此,开发KRAS G12D抑制剂不仅有着广阔的市场前景,也是守护数百万患者生命健康的迫切需求。
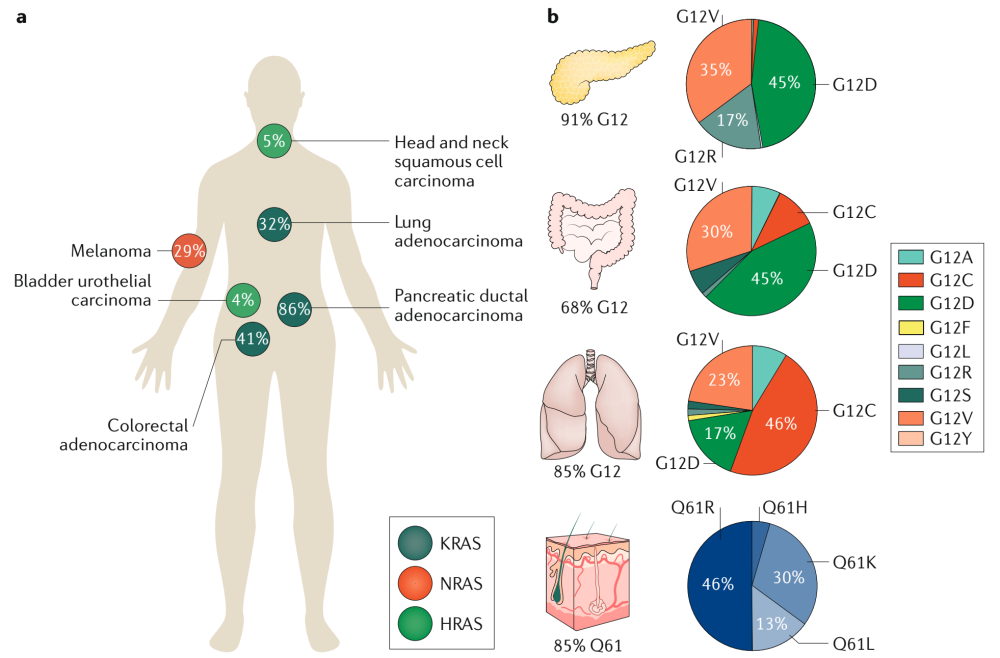
图片来源:Moore, A.R., Rosenberg, S.C., McCormick, F. et al. RAS-targeted therapies: is the undruggable drugged. Nat Rev Drug Discovery 19, 533–552 (2020).
目前,全球仅MRTX1133一款口服G12D抑制剂于2023年1月获得FDA批准,即将进入一期临床研究,其他口服G12D抑制剂均处于临床前研究阶段。MRTX1133已发现两年多,之前由于口服生物利用度极低,一直未能申报IND,最后虽然通过制剂手段实现了口服给药,但暴露量也仅仅提高了10倍左右,生物利用度仍然很低,存在很大的提高空间。总之,KRAS G12D抑制剂的开发存在很高的技术壁垒,不仅要突破G12D难成药的障碍,还要解决口服药代差的国际性难题。面对庞大而迫切的未被满足的临床用药需求,对药物研发者来说,KRAS G12D抑制剂的开发既是重大挑战也是难得的机遇。
海博为药业KRAS G12D抑制剂的研究进展
海博为药业研发团队覆盖创新药研发全链条各个领域,拥有深厚的药物研发专业知识和丰富的实战经验。经过一年多的努力,已确定适用于口服给药的KRAS G12D抑制剂临床前候选化合物(PCC)HBW-012-D,该化合物在无制剂手段的情况下暴露量就能达到MRTX1133的10倍至50倍,基本解决了G12D抑制剂口服药代差的国际性难题,目前该项目已全面启动临床前申报研究,计划在2023年提交IND。
在头对头体外成药性对比研究中,在对AGS-pERK的抑制方面,HBW-012-D的IC50值约为MRTX1133的二分之一;在对胰腺癌细胞增殖的抑制方面,HBW-012-D的IC50值约为MRTX1133的三分之一;在对结肠癌细胞增殖的抑制方面,HBW-012-D的IC50值约为MRTX1133的二分之一;总之,在对肿瘤细胞的抑制方面,HBW-012-D明显优于MRTX1133。此外,HBW-012-D对野生型KRAS(MKN-1细胞)及hERG基本没有抑制作用,说明其安全性良好。
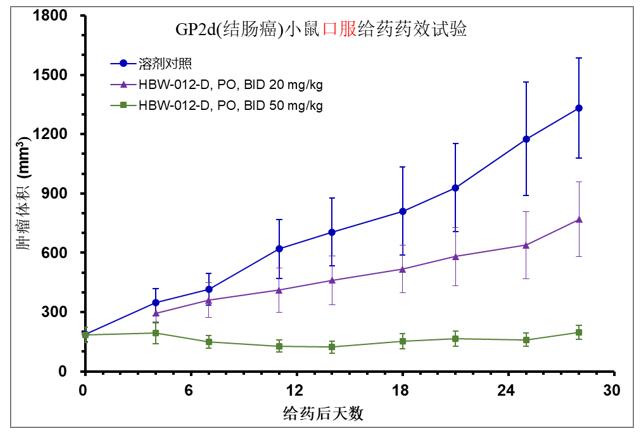
在GP2d(结肠癌)小鼠口服给药药效试验中,化合物HBW-012-D在20mg/kg及50mg/kg口服BID给药条件下可显著抑制肿瘤增长。HBW-012-D在肿瘤组织中的药物浓度显著高于血浆药物浓度,50mg/kg剂量下的比值达到40倍以上。提示HBW-012-D对肿瘤具有很好的靶向性及治疗作用。

Contact:Miss Jiang
Telephone:028-87014968
Email:xiameijiang@hyperwaypharma.com
Address:8Th Floor, Building B4, Tianfu Life Science Park, No.88, Keyuan South Road, Hi-Tech Zone, Chengdu, Sichuan