2023年1月27日,礼来第三代(非共价)BTK(布鲁顿酪氨酸激酶)抑制剂Pirtobrutinib (LOXO-305) 获FDA加速批准上市,用于治疗至少两种系统治疗(包括BTK抑制剂)后复发或难治性套细胞淋巴瘤(MCL)的成年患者,这是FDA批准的首个也是目前唯一一个非共价BTK抑制剂。
目前普遍认可的非共价BTK抑制剂除LOXO-305外,还有最近刚进入临床三期默沙东的MK-1026(ARQ-531)。海博为药业研发的HBW-3220在临床前研究中,与礼来的LOXO-305、默沙东的ARQ-531做了多项头对头对比(主要测试均在药明康德,康龙化成等CRO公司进行),均显示出明显优势,同时也在临研究中开始展现类似优势!
BTK是B细胞受体信号传导通路的关键调节因子,已被证实与多种B细胞肿瘤及自身免疫性疾病相关,市场前景极富魅力。据弗若斯特沙利文分析,未来BTK抑制剂市场将持续扩大,预计全球市场2025年达到200亿美元,2030年达到261亿美元。此外临床对比研究也已证实BTK抑制剂在慢性淋巴细胞白血病(CLL)的效果显著优于CD20单抗(如利妥昔单抗、奥法木单抗)。因此预计至少未来十年,BTK抑制剂都将在B细胞淋巴瘤及白血病治疗领域占主导地位。
体外激酶抑制活性研究
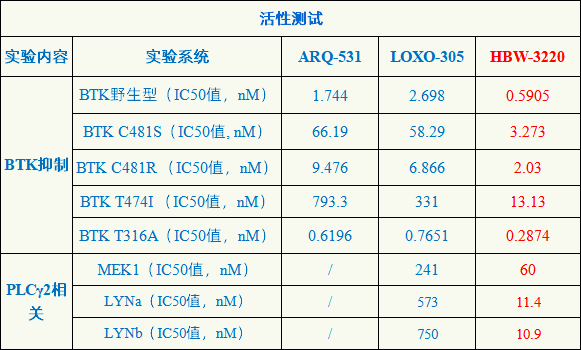
头对头研究数据表明,HBW-3220对野生BTK和BTK-C481S突变及其他相关BTK突变抑制作用均优于LOXO-305及ARQ-531,提示HBW-3220除了适用于因服用伊布替尼(Ibrutinib)等共价BTK抑制剂产生耐药的患者外,同样也适用于一线B细胞肿瘤患者;HBW-3220对SRC家族激酶LYN(BCR上游分子)和ERK上游激酶MEK1(BCR下游分子)的抑制作用也明显优于LOXO-305,推测HBW-3220对PLCγ2突变患者也可能有效(LOXO-305目前未见相关报道,可能对这部分病人无效)。
伊布替尼等共价BTK抑制剂耐药主要和BTK-C481S突变及PLCγ2(BTK下游分子)突变有关。BTK-C481S突变通过阻止不可逆药物结合对伊布替尼产生耐药;PLCγ2突变容许BCR介导的不依赖于BTK的信号通路激活对伊布替尼产生耐药。HBW-3220通过同时抑制BCR上下游信号分子,包括SRC家族激酶LYN(BCR上游分子)和ERK上游激酶MEK1(BCR下游分子),抑制PLCγ2突变引起的BCR下游信号通路的激活。HBW-3220对BTK-C481S突变及PLCγ2(BTK下游分子)突变患者很可能都有效,临床适应性更广。
体内大鼠药代比较研究
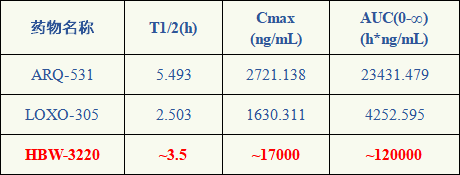
相同剂量(10mg/kg,PO)大鼠药代研究显示,HBW-3220的AUC是ARQ-531的5倍以上,是LOXO-305的27倍以上。
体内相关药效模型研究
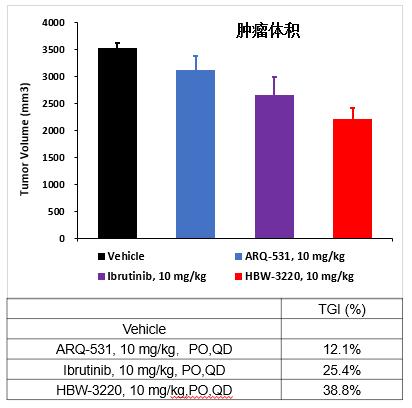
TMD8(弥漫大B细胞淋巴瘤)小鼠皮下瘤药效模型预实验
TMD8(弥漫大B细胞淋巴瘤)小鼠药效模型实验显示,采用相同剂量(10mg/kg)及给药方式和频率(PO,QD),HBW-3220肿瘤抑瘤率是ARQ-531的3倍,是伊布替尼的1.5倍,优势明显且荷瘤鼠耐受性良好。
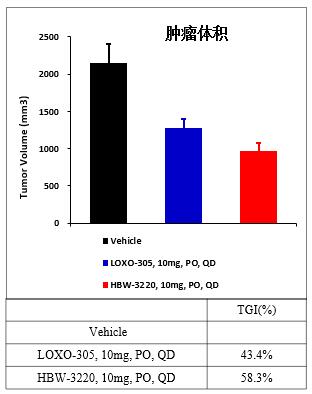
TMD8(弥漫大B细胞淋巴瘤)小鼠皮下瘤药效模型预实验
同样的TMD8药效模型比较研究显示,HBW-3220对肿瘤的抑制作用也明显优于LOXO-305,且荷瘤鼠耐受性良好。
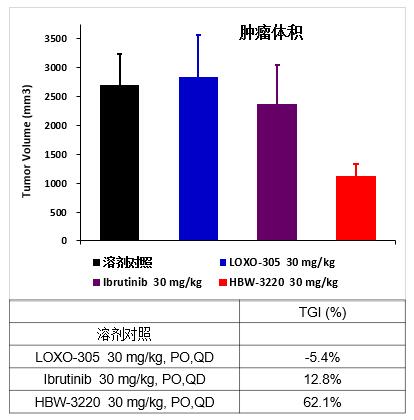
DOHH2(滤泡性淋巴瘤细胞)小鼠药效模型实验
DOHH2(滤泡性淋巴瘤细胞)小鼠药效模型实验显示, LOXO-305对肿瘤没有抑制作用,伊布替尼只有微弱的抑制效果,HBW-3220对肿瘤的抑制效果明显优于LOXO-305和伊布替尼。目前上市的所有BTK抑制剂药物对DOHH2(滤泡性淋巴瘤细胞)亚型淋巴瘤疗效都很差,HBW-3220可能对该类病人会产生良好的治疗效果,取得非常好的临床差异化优势。
临床前大鼠毒理研究
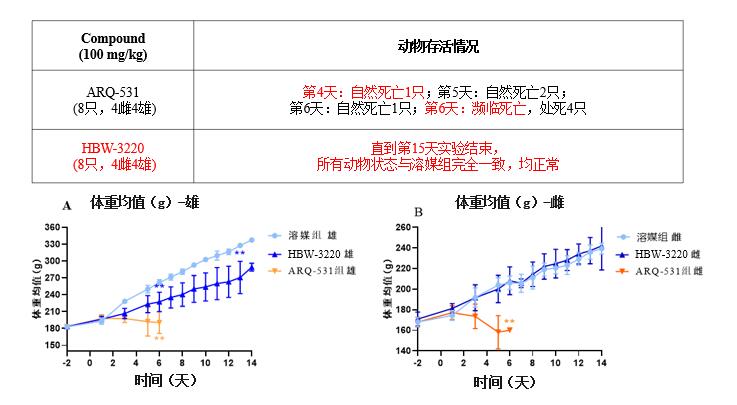
大鼠毒理预实验
安全性方面,HBW-3220与ARQ-531头对头连续给药14天毒理研究显示:ARQ-531组在实验第4天开始出现大鼠死亡,第6天全部濒临死亡;HBW-3220组直到第15天实验结束,所有动物状态均正常,且体重一直在平稳增长,其安全性比ARQ-531高很多!
Ⅰ期临床研究
HBW-3220是海博为药业自主开发的三代抗耐药、可逆(非共价)BTK抑制剂,已进入I期临床研究。截至目前,HBW-3220已入组10例患者,开展15mg、30mg、60mg、90mg四个剂量患者入组的剂量爬坡研究。在已经初步评估的7例患者中,已获得的数据显示HBW-3220具有很好的人体药代动力学特征,且所有患者均未发生DLT(剂量限制毒性)事件,安全性良好。某剂量组1例边缘区淋巴瘤患者(MZL)服药第2周期后就达到完全缓解(CR),鼻咽左侧结外病灶(2cm*1cm)完全消失,服药后5个周期疗效评估仍然为CR。某剂量组3例患者首次疗效评价为疾病稳定(SD),肿瘤均有缩小。某剂量组1例MCL患者(01-007)第3周期靶病灶总和减小41%。
总体来看,HBW-3220不仅对野生型和C481S突变型B细胞淋巴瘤有良好的治疗作用,推测对PLCγ2突变引起的耐药患者也可能有很好的治疗效果,且全面优于LOXO-305。另外,HBW-3220在发病率较高的弥漫大B细胞淋巴瘤(发病率占成人非霍奇金淋巴瘤的35%-50%)和难治性滤泡性淋巴瘤(发病率占成人非霍奇金淋巴瘤的20%-30%)的治疗方面优势显著,在套细胞淋巴瘤的治疗上也有着极大的潜力和优势。同时海博为药业还启动了HBW-3220在肾病领域新适应症的临床前研究,预计将在2023年申报该适应症的临床研究。海博为药业将全力推进该项目的临床研究,争取早日造福广大患者!

联系人:姜女士
电话:028-87014968
邮件:xiameijiang@hyperwaypharma.com
地址:成都市高新区科园南路88号天府生命科技园B4栋8楼